Nitrogliserin?? apaan tu?? obat kumur?? bukan, itu listerin!! o.o
nah biar ga salah konsumsi obat nitrogliserin, yuk disimak dan dibaca artikel saya dibawah ini :)
check it
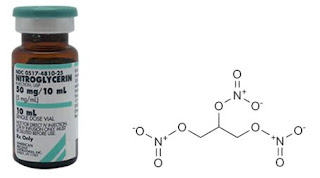 |
| Struktur Nitrogliserin |
Nitroglycerin atau GlycerylTrinitrate merupakan sebuah vasodilator (pelebaran pembuluh darah) yang mudah menguap, yang dapat mengurangi angina pectoris dengan cara merangsang guanylate cyclase dan merendahkan kalsium sitosolik. Nitroglycerin digunakan untuk pengobatan angina pectoris dan hipertensi, untuk menghasilkan hipotensi yang terkontrol selama pembedahan dan untuk mengobati gagal jantung.
- Sifat Fisikokimia
Nitrogliserin
berbentuk gas yang mudah meledak dan mudah terbakar, berwarna putih atau kuning
pucat. Nitrogliserin yang tidak diencerkan sukar larut dalam air; larut dalam
metanol,etanol, karbon disulfida, aseton, etil eter, etil asetat, asam asetat
glasial, benzena, toluena, nitrobenzena, fenol, kloroform dan metilena klorida.
- Keterangan :
Nitrogliserin berbentuk gas yang mudah meledak
dan mudah terbakar, berwarna putih atau kuning pucat. Nitrogliserin yang tidak
diencerkan sukar larut dalam air; larut dalam metanol,etanol, karbon disulfida,
aseton, etil eter, etil asetat.
- Indikasi
Pengobatan
angina pektoris; bentuk injeksi IV digunakan untuk gagal jantung kongestif
(terutama bila disebabkan infark miokard akut); hipertensi pulmoner; emergensi
hipertensi selama operasi (terutama selama pembedahan jantung)
- Dosis,
Cara Pemberian dan Lama Pemberian
Untuk
mengendalikan tekanan darah selama anestesi; pemberian IV untuk pengobatan
gagal jantung akut atau edema paru, angina pektoris akut atau angina tidak
stabil, infark miokard akut, hipertensi paru akut; pengobatan hipertensi berat,
hipertensi postoperasi, hipertensi perioperative (mis.selama pembedahan
jantung), atau emergensi hipertensi: dosis intravenous:
·
Dewasa: Awal, 5
mcg/menit infus IV.,tingkatkan sebanyak 5 mcg/menit IV setiap 3-5 menit sampai 20 mcg/menit sampai didapat respon
klinis; jika tidak ada respon pada 20 mcg/menit,tingkatkan dosis sebesar 10
mcg/menit setiap 3-5 menit sampai 200 mcg/menit.
· Usila: Pemberian dosis awal serendah mungkin dan
tingkatkan hingga efek klinik tercapai. Usila lebih sensitif terhadap efek
hipotensi dan bradikardi dari nitrogliserin.
· Anak-anak: Dosis Awal, 0.25-0.5 mcg/kg/menit melalui
infus IV (intravena), titrasi 1 mcg/kg/ menit pada interval waktu 20-60 menit untuk mendapat efek
yang diinginkan. Dosis umum adalah 1-3 mcg/kg/menit, maksimum 5 mcg/kg/menit.
- Farmakologi
Onset
pemberian nitrogliserin: IV, segera. Durasi aksi pemberian IV : 3-5 menit.
Nitrogliserin terdistribusi luas di dalam jaringan dengan persentase sekitar 60%nya terikat
protein. Metabolit nitrogliserin, 1,3- dan 1,2-glyceryl dinitrate, tidak
seefektif nitrogliserin dan memiliki T½ sekitar 40 menit, dibanding dengan
nitrogliserin yang hanya 1-4 menit. Metabolit ini diekskresikan melalui ginjal.
- Stabilitas Dalam Penyimpanan
Stabil di dalam D5LR, D51/2NS, D5NS, LR, 1/2NS. Kompatibilitas ketika di campur: Dosis
bervariasi dan membutuhkan titrasi, sehingga pencampuran dengan obat lain tidak disarankan. Kompatibel: Alteplase, aminofilin, dobutamin, dopamin, enalaprilat,
furosemid, lidokain, verapamil. Incompatible: hidralazin, fenitoin.
- Kontraindikasi
· Hipersensitif
terhadap nitrat organik; hipersensitif terhadap isosorbide, nitrogliserin, atau
komponen lain dalam sediaan, penggunaan bersama penghambat phosphodiesterase-5
(PDE-5) seperti sildenafil, tadalafil, atau vardenafil; angle-closure
glaucoma (terjadi peningkatan tekanan
intraokuler); trauma kepala atau perdarahan serebral (meningkatkan tekanan
intrakranial); anemia berat.
· Kontraindikasi
IV: Hipotensi; hipovolemia yang tidak terkoreksi; gangguan sirkulasi serebral;
constrictive pericarditis; perikardial tamponade karena obat mengurangi aliran
darah balik, mengurangi preload dan mengurangi output jantung sehingga
memperparah kondisi ini.
· Nitrogliserin
jangan diberikan pada pasien hipovolemia yang tidak terkoreksi (atau dehidrasi)
karena risiko menginduksi hipotensi,gangguan sirkulasi serebral, perikarditis
konstriktif, pericardial tamponade.
· Nitrogliserin harus digunakan hati-hati pada
pasien hipotensi atau hipotensi ortostatik karena obat ini dapat memperparah
hipotensi, menyebabkan bradikardi paradoksikal, atau memperberat angina.
·
Terapi nitrat
dapat memperberat angina karena kardiomiopati hipertropik.
· Penggunaan
nitrogliserin pada awal infark miokar akut perlu pemantauan hemodinamika dan
status klinis.
· Nitrogliserin
harus digunakan hati-hati setelah infark miokardiak karena hipotensi dan
takikardia dapat memperparah iskemia.
Efek
Samping
· Kardiovaskuler:
Hipotensi, hipotensi postural, pallor, kolaps kardiovaskuler, takikardi, syok,
kemerahan, edema perifer.
· SSP: sakit kepala
(paling sering), pusing (karena perubahan tekanan darah), tidak bisa tidur.
·
Gastrointestinal:
Mual, muntah, diare.
·
Genitourinari:
inkontinensia urin.
·
Hematologi:
Methemoglobinemia (jarang, bila overdosis).
·
Neuromuskuler
& skelet: Lemah/letih.
· Mata: Pandangan
kabur. Insiden hipotensi dan efek yang tidak diharapkan akan meningkat jika digunakan bersama sildenafil (Viagra®).
- Interaksi
· Dengan Obat Lain
: Pemberian bersama dengan alkaloid ergot
potensial dapat menyebabkan vasospasme koroner dan dapat memperberat angina. Alkaloid
ergot kontraindikasi pada pasien angina, hipertensi atau penyakit arteri
koroner yang mendapatkan terapi nitrogliserin. Penggunaan bersama obat simpatomimetik (dapat meningkatkan tekanan darah dan nadi) seperti norepinefrin, epinefrin, fenilefrin, efedra, atau efedrin, bersifat antagonis efek
antiangina dari nitrat. Efek vasodilatasi nitrat dapat menghambat efek
adrenergik alfa dari epinefrin sehingga memperberat takikardi dan hipotensi
berat. Nitrit dan nitrat merupakan antagonis asetilkolin dan histamin.
Sehingga, nitrogliserin dapat mengurangi efek obat ini (mis, asetilkolin,
norepinefrin dan histamin dihidroklorid) bila digunakan bersama.
- Pengaruh
· Terhadap
Kehamilan : Nitrogliserin
diklasifikasikan dalam kategori C pada kehamilan. Meskipun tidak dilakukan
penelitian pada manusia, tetapi penelitian pada binatang menunjukkan adanya
efek yang tidak diharapkan pada janin. Jadi apabila memutuskan pemberian obat
ini pada kehamilan, harus dipertimbangkan keuntungan terhadap ibu dan risikonya
terhadap janin.
· Terhadap Ibu
Menyusui : Belum diketahui apakah nitrogliserin atau metabolitnya diekskresikan didalam ASI. Karena banyak obat yang diekskresikan didalam ASI, perlu hati-hati jika diberikan
pada ibu menyusui.
· Terhadap
Anak-anak : Keamanan dan efektivitas
nitrogliserin pada anak-anak belum diketahui.
- Peringatan
Dapat
terjadi hipotensi yang berat. Gunakan hati-hati pada hipotensi, hipovolemia,
dan infark ventrikel kanan. Selain hipotensi, juga disertai bradikardi
paradoksal dan angina pektoris. Dapat juga terjadi hipotensi postural. Dapat
terjadi toleransi terhadap nitrat, diperlukan perhitungan dosis yang tepat untuk
meminimalkan efek samping ini. Keamanan dan efikasi tidak diketahui bila digunakan pada
pasien anak-anak. Hindari penggunaan jangka panjang pada pasien penderita infark
miokard akut atau gagal jantung kongestif. Nitrat dapat memperparah angina yang
disebabkan oleh kardiomiopati hipertropik. Nitrat dapat memperberat angina yang
disebabkan kardiomiopati hipertropik.
- Mekanisme
Aksi
Bekerja
dengan relaksasi otot polos, menghasilkan efek vasodilator pada vena perifer
dan arteri, dengan efek paling penting pada vena. Menurunkan kebutuhan oksigen
jantung dengan mengurangi preload (ventrikel kiri-tekanan diastolik); serta
mengurangi afterload; dilatasi arteri koroner dan memperbaiki aliran kolateral
pada daerah iskemik.
- Monitoring
Penggunaan Obat
Kaji
potensial interaksi dengan obat-obat lain yang diminum pasien (mis, heparin,
alkaloid ergot, sildenafil, tadalafil, atau vardenafil). Evaluasi efektivitas
terapi (status kardiak) dan efek yang tidak diharapkan (mis, hipotensi,
aritmia, perubahan SSP, gangguan GI).Dosis harus diturunkan bertahap pada
penghentian obat setelah penggunaan jangka waktu lama. Informasikan pada pasien
tentang penggunaan obat, kemungkinan efek samping/intervensi (mis, periode
bebas obat) dan pelaporan efek yang tidak diharapkan.
Literature
·
Pearce, Evelyn C.
2002. Anatomi dan Fisiologi untuk Paramedis. Jakarta : Gramedia Pustaka Umum.
·
Nugroho, A.E.
2013. Farmakologi. Jakarta : Pustaka Pelajar.
·
Universitas
Indonesia, FK. 1995. FARMAKOLOGI dan TERAPI Edisi 4. Jakarta : FK UI.
· Nafu, H.M.S. 2011.
Medical Management of Angina Pectoris. https://id.scribd.com/doc/61601638/Jurnal-Angina.
25 januari 2017.
------------------------------------------------------------------------------------------------------
gimana sekarang jadi lebih tahu kan tentang obat nitrogliseryn?
jangan sampe salah konsumsi ya :D
klo ada pertanyaan silahkan masukan di kolom komentar ya..
buat yang suka artikel saya silahkan berlangganan dan g+ nya dulu donk hehe..
jangan bosan membaca dan jangan bosan mampir di blog saya hehe..
sekian dari saya, see you next article :)





